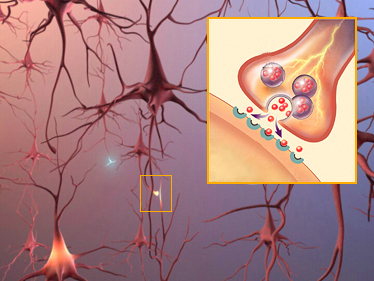
神經突觸傳輸
腦中約有一千億的神經細胞,平均每個細胞都直接與其他1000 個神經細胞作用。1930 到1960 年的研究指出,神經間的溝通主要透過電子傳遞或化學作用傳輸兩種方式,腦中的突觸約99%會使用到化學作用傳輸。Greengard 在2001 的文獻中提到,在神經細胞的化學傳輸方式中,被廣為所知的是快速與慢速突觸傳輸兩種機制。在腦中快速突觸傳輸有一半是興奮性,且大部份以glutamate 作為其神經傳導物質。另一半的快速突觸傳輸是抑制性的,且大部分以GABA 為其神經傳導物質。快速神經突觸傳輸,發生時間少於0.001 秒。這是因為快速作用的神經傳導物質打開突觸後細胞膜上的ligand-operated 離子通道所致。在興奮性的快速突觸傳輸中,glutamate 鍵結到受體上,造成受體結構的電位改變,帶正電的鈉離子衝進細胞引起去極化,此為興奮性作用。而跟glutamate 相關的受體,有N-methyl-D- aspartate (NMDA)、α-amino-3-hydroxy-5-methyl-4-isoxazolepropionic acid (AMPA)、kainate 三個受體。在抑制性的快速突觸傳輸中,GABA 鍵結到受體上,使受體結構改變,帶負電的氯離子滲透入細胞,引起細胞過極化,此為抑制性作用。除此之外,鍵結上nicotine acetylcholine receptor (nAChR)的acetylcholine (ACh),也是快速作用的神經傳導物質。慢速突觸傳輸發生時間約在數百毫秒到幾分鐘之間,比快速突觸傳輸更為複雜。生物胺、胜肽、氨基酸這三種組成是目前認定為慢速突觸神經傳導物質。此外,快速動作的神經傳導物質,包含glutamate與GABA 所產生的影響,也有很多是透過慢速突觸傳輸路徑。慢速動作神經傳導物質,鍵結上受體後,會改變第二訊息 (如:cAMP、cGMP、calcium、diacyglyverol),並活化蛋白質激酶,使其磷酸化改變下游生理影響子的受質蛋白 (Greengard, 2001)。
尼古丁菸鹼性受體 (nAChR)
Nicotinic acetylcholine receptor (nAChR),因此受體與尼古丁(菸鹼)的結合比acetylcholine強,而命名之。這類受體位於神經肌肉接合處及自主神經節,突觸前與突觸後都有發現其存在。nAChR是很典型的配體閘控神經傳導物質的離子通道 (ligand-gate ion channel ),為五聚合體結構的跨膜蛋白質,跟5-HT3、GABAA、GABAC和glycine受體是屬於同一基因家族的同源受體 (Corringer et al., 2000; Karlin, 2002)。主要藉由調節神經傳導物質的釋放來影響並改變神經元細胞的成長與再生 (Gray et al.,1996)。nAChR與muscarinic AChR不同的是,其含有五個亞型 (M1 -M5),藉著活化G蛋白來調節細胞回應 (Slutsky et al., 2001; Wess, 1996)。主要含有五種次單元,分別為α、β、γ、δ、ε,廣泛在肌肉、中樞神經、及自律神經節中表現。而目前可被辨識的有12 個不同次單元,為α2-α10,β2-β4 (Changeux and Edelstein, 2001)。每個次單位在N端都含有一個親水基,M1-M3 等三個跨膜部分接在其後,M3 與M4 在細胞內以大環連接,M4 另一端有C端延伸到細胞外 (Karin, 2002; Linstrom, 2000)。
nAChR 與許多疾病相關。如抗體對抗muscle nAChR 造成自體免疫重症肌無力 (Abramsky, 1980)、天生的重症肌無力是起源於nAChR 突變(Engel et al., 1996)。神經退化性疾病,如愛滋海默症、帕金森氏症,與nAChR 大量失去有關。Autosomal dominant nocturnal frontal lobe epilepsy(ADNFLE)與α4 或β2 突變有關 (Steinlein et al., 1995; De Fusco et al.,2000)。
伽傌胺基丁酸gamma-amino butyric acid (GABA)
(一) GABA
GABA 在腦中的含量約是其他單胺類神經傳遞物質的200 至1000倍,GABA 最早是在1950 年時由Eugene Roberts 及J Awapara 在實驗動物的大腦中發現,經純化分離後確定是一種中性氨基酸。接下來在1950至1965 年間,藉由電生理研究進一步證實GABA 在哺乳類中樞神經系統是一個重要的抑制性神經傳導物質,約有20~50%的中樞神經元突觸末稍釋放此抑制性神經傳導物質,並且分佈於腦部特定的區域 (Bloom et al.,1971; Sieghart, 1995)。
(二) GABA 受體的分類
在中樞神經系統中, GABA分布和作用非常廣泛。最初研究GABA受體時,藉由電生理和藥物結合實驗的方法,首先發現GABA可以活化對bicuculline敏感的氯離子通道,接下來又發現另一類可以被GABA活化的陽離子通道。GABAA為突觸後接受體,分布於突觸後神經元,是由配體調控的氯離子通道 (ligand-gated chloride channel)。此受體在1980 年代被分離及純化;隨後基因也被選殖,發現核酸序列和配體控制的離子通道,和乙醯膽鹼受體 (ACh receptor) 和glycine受體很接近 (Schofield et al.,1987)。此受體上除了有GABA結合位點,也發現許多藥物的調節位點(modulatory binding sites)包括:BZs、巴比妥鹽類、神經類固醇 (neurosteroids)和酒精等。而由藥物結合實驗證實,其所作用的受體依照藥理作用特性可分成三類:GABAA、GABAB、GABA B C受體,表達在中樞神經系統的主要是GABAA、GABABB這兩類受體 (Borman, 1988; Bowery, 1989)。
GABAA受體
GABAA受體是鎮靜催眠藥的作用目標。GABAA受體由五個多胺鏈組成,這多胺鏈由多種次單元 (α,β, γ,δ, ε,π,θ) 構成 (Ticku et al.,1999; Whiting, 1999),其分子量約為50-60 KDa,這些次單元會形成五合體(pentamer),包圍著氯離子通道而形成一個分子量約220 至300 kd的多胺鏈醣蛋白體,這就是GABAA受體 (Sigel et al., 1983; Olsen and Tobin, 1990)。當GABA與GABAA受體結合時,氯離子通道會迅速開啟,導致突觸後細胞膜的氯離子通透性增加,大量的氯離子會進入突觸後神經元並使得瞬間電流改變,持續時間約1~10 毫秒(ms),使興奮性神經傳導物質去極化效果降低,達到抑制的效果 (Macdonald et al., 1994)。
GABAA受體可被GABA、muscimol和isoguvacine活化;而bicuculline、gabazine (SR95531)和(+)-β−hydrastine可抑制GABAA受體活性。研究報告也指出在多種癲癇發作時,發現和GABAA受體被刺激有關 (Brenda et al.,2005)。
GABAB受體
第二種在中樞神經系統發現的GABA受體稱做GABAB受體,位於突觸前末梢,在電生理特性及結構上皆不同於GABAA受體,屬於代謝型(metabotropic)受體家族的一種。當GABA結合上GABAB受體後,GABAB受體經由GTP結合蛋白 (G protein)和第二訊息傳遞物質 (second messengers)之作用,使鉀離子及突觸前鈣離子通道開啟,造成神經元細胞內陽離子外流,產生神經元膜電位抑制作用 (Marshall et al., 1999)。GABAB 受體在癲癇疾病的角色是很複雜的,目前研究以其受體增效劑或拮抗劑而言,因為痙攣刺激的不同會有促痙攣與抗痙攣兩種不同效果 (Gasior et al.,2004)。
麩胺酸(Glutamate),興奮性胺基酸
L-glutamate 是中樞神經中主要的興奮性神經傳導物質,腦中50%以上的突觸是以glutamate 為傳導物質的興奮性突觸。根據活化劑選擇性的不同,可將glutamate 受體分成三類:能被-methyl-D-aspartate (NMDA)選擇性活化的受體稱為NMDA 受體,對AMPA 有較高敏感性的受體稱為AMPA 受體,對海藻人酸 (kainic acid, KA)敏感的受體稱為KA 受體。這三類受體皆為配體柵欄離子通道受體。20 世紀80 年代中期發現一類與G蛋白偶合的glumate 受體,被活化後影響phospholipids 代謝或cAMP 活性,導致突觸後第二訊息如IP3、DAG、cAMP 濃度的變化,故稱為親代謝型麩胺酸受體 (metabotropic receptor) (Robinson and Doed, 1997)。
NMDA 受體
在哺乳動物腦部的glutamate突觸,大部分會同時存在NMDA受體與AMPA/kainate受體。在突觸前神經元釋放glutamate後,結合到突觸後glutamate受體上,AMPA/kainate受體會開啟並產生一個快速的EPSCs,之後經由NMDA受體所產生的EPSCs才會發生。相較於其他的glutamate受體,NMDA受體的離子通道,對於Ca2+的通透性極高 (Macdermott et al.,1986),由NMDA受體所產生的EPSCs,會造成突觸後神經元的細胞內Ca2+濃度增加,以活化一系列的訊息傳遞。而NMDA受體其他的生理特性,還包括了活化受體時必須存在glycine (Kaplita and Ferkany, 1990);細胞外
Mg2+會經由voltage-dependent來阻斷離子通道,而此阻斷作用是發生於過極化 (hyperpolarized)電位 (Nowak, 1984; Seeburg, 1993);以及NMDA受體所產生的slow EPSCs (Johnson and Ascher, 1987; Lester et al., 1990;Mcbain and Mayer, 1994)。
NMDA 受體是一種甜甜圈型的結構 (Collingridge et al., 1995),中間的離子通道則能容許鈣離子通過,使細胞內鈣離子濃度增加;而鎂離子則會阻斷NMDA 的鈣離子通道。內流的鈣離子會活化細胞內的酵素,並對神經造成長時間的改變,尤其是突觸的功能。NMDA 受體的次單元家族分為以下三類:NMDAR (NR1)、NMDAR2 (NR2)及NMDAR3 (NR3)。
在生物體中的NMDA 受體,往往由兩個NR1 次單元與兩個NR2 次單元所組成。一般說來,NR1 次單元只有一條多胜鏈所構成,在NMDA 受體中扮演著離子通道的部分,並在各個腦區都有分佈 (Zukin and Bennett,1995)。而NR2 次單元可在細分為4 個家族 (A 到D) (Ikeda et al ., 1992),而每個次單元個別存在時都不具功能;而與NR1 次單元共同存在於,則會加強NR1 次單元的作用。而各種NR2 受體次單元在大腦中的表現區域都不同,如NR2A 及NR2B 主要是表現在neocortex 及海馬迴;NR2C 則是在小腦區的表現較明顯;NR2D 則是表現在中腦的組織中,如視丘(Monyer et al., 1994; Standaert et al., 1996)。過去的研究指出在癲癇病人腦的海馬迴發現,NR2B 的蛋白質和mRNA 表現量有明顯增加 (Crino et al.,2001)。
AMPA 受體
AMPA 受體由四個同源次單元兩兩組成:GluR1、GluR2、GluR3、GluR4。隨著不同腦區及細胞生長階段會有不同組成的AMPA 受體以因應不同的生理需求。他們具有相似的細胞外大N 端、三個跨膜區,以及含所有已知激酶磷酸化位置和突觸蛋白質鍵結位置的細胞內C 端,此區在不同的次單元中差異較大,是負責主要調節AMPA 受體功能的區域。受體興奮時離子通道開啟僅允許鈉、鉀單價陽離子進出,胞外鈉離子內流引起突觸後膜去極化,誘發快速的EPSP,參與興奮性突觸的傳導。
AMPA 受體在腦內的分不與NMDA 受體幾乎平行,也是在海馬及大腦皮質分佈最密集,顯示這兩種受體在突觸傳導過程中有協同關係。早期的研究也顯示,AMPA 受體在癲癇發作中扮演很重要的角色 (Rogawski andDonevan, 1999)。
Adrenergic receptor(腎上腺素受體)
腎上腺素受體,是兒茶酚胺 (catecholamine)的標的結合受體,也是G蛋白耦聯受體超家族中最具代表性的成員之一。作為交感神經傳導物質的正腎上腺素 (noradrenaline)及內分泌激素的腎上腺素 (adrenaline),正是通過與靶器官上的腎上腺素受體結合,激發一系列的細胞內信號傳遞與物質,從而完成化學信號的轉換,參與體內多數器官生理功能的調節。受體結構、分佈與功能的異常往往與相應器官的病理改變緊密相連。很多證據指出中樞的正腎上腺素,在控制癲癇閾值機制上是很重要的,不過目前對於是促進或抑制並沒有定論。中樞腎上腺系統被刺激或抑制都會誘發痙攣和抗痙攣的作用發生 (Dadkar et al., 1979)。腎上腺素受體位於交感節後神經元所支配的器官上。受體大致上可分為α1、α2、β1、β2。
腎上腺素α受體
α1受體會被phospholipase C 活化,並形成IP3 與DAG,也會使細胞內鈣離子增加。主要位於皮膚和腸胃系統血管平滑肌上,被刺激時造成血管收縮。當人遇到挑戰或逃避反應時,會減少血流到器官,造成臉色蒼白。而α1 受體的增效劑效力依順序排列為: phenylephrine>adrenaline>noradrenaline。拮抗劑為prazosin、phenoxybenzamine。研究指出,大腦皮質中的α1 受體改變會造成癲癇發作 (Gundlach et al.,1995)。α2受體在突觸前後的神經末端都可發現。藉由不活化adenylate cyclase 與減少細胞內cAMP 濃度,來活化α2受體。Clonidine、α-methylnorepinephrine 為其選擇性增效劑藥物。Yohimbine、tolazoline 為其專一性拮抗劑。給予α2受體拮抗劑會增加癲癇發作 (Gellman et al.,1987)。
腎上腺素β受體
β受體都會活化adenylate cyclase,增加細胞內cAMP 濃度。β1 受體位於心臟,藉由活化心臟節點細胞引成心跳增加。心絞痛的治療藥物,β受體抑制劑常常被使用原因即是如此。β2受體位於支氣管平滑肌上,會造成肌肉舒張引起支氣管擴張。會造成血管擴張,使更多血液流入肌肉並減少周圍阻力,而引起肌肉和肝的血管擴張或子宮內肌肉舒張,並釋放胰島素。文獻中發現,單獨給予β受體的拮抗劑會誘發小鼠癲癇發作,且其機制可能是透過β受體調節 (Amabeoku and Syce, 1997)。
原作者:國立成功大學醫學院環境醫學研究所 研究生:萬昌鑫
原文出處:多種受體在芝麻酚引起癲癇發作中扮演的角色
Roles of multiple and plastic receptors in sesamol-initiated seizures in mice 中華民國九十五年六月
文章標籤
全站熱搜




 留言列表
留言列表
 線上藥物查詢
線上藥物查詢 