ATP是對你生命中最重要的東西,不過你可能不是很瞭解他到底有哪些功能。
資料來源:Scientific American 2009-12
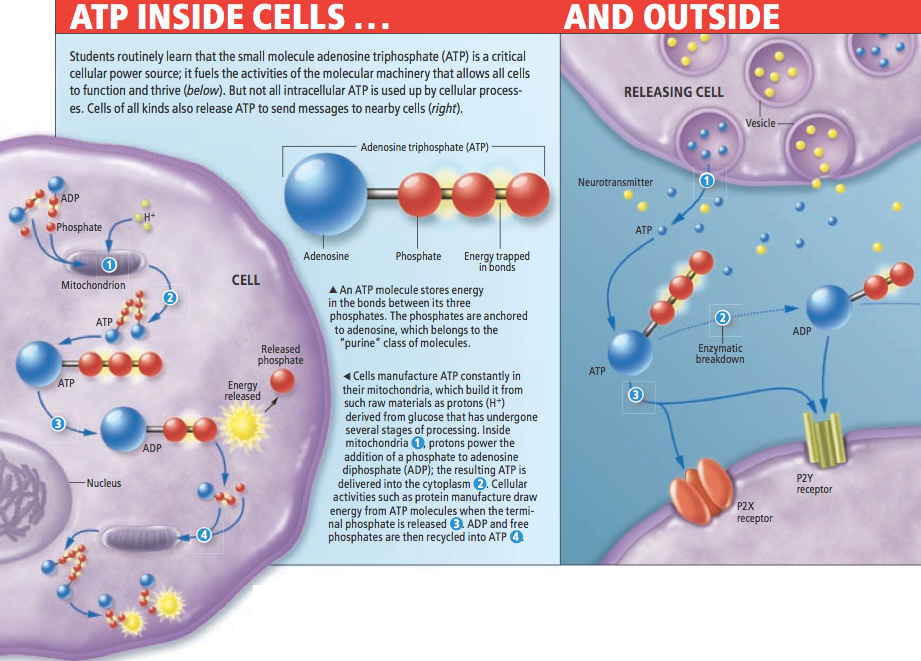
大部份學生在上生物課的時候,最先學到、也最難忘的基本觀念,就是所有的活細胞都是以三磷酸腺苷(adenosine triphosphate, ATP)為「燃料」。這種生物界通用的能量貨幣驅動了生物反應,使細胞得以正常運作、生命能夠蓬勃發展,也讓ATP成為生物世界裡的要角。
然而大家或許不知道,這個可能是人體製造最多也消耗最多的分子,在細胞外還有一個完全不同、但同等重要的身份:一連串詳盡的研究證明,ATP也是全身細胞及組織用以互相溝通的重要訊號分子。因此它除了是生物界通用的燃料外,事實上還是一種共通的語言。
50年前,ATP具有雙重功能的概念剛被提出時,遭遇了相當多的質疑;但過去15年來,一波波的發現詳述了ATP在細胞外的作用,以及它在器官組織的發展與運作上扮演的角色。由於ATP在生物體內無所不在,其傳訊活動對生理功能有廣泛的影響,提供了多種機會來改善人體健康,現在全世界實驗室都競相把這些觀念轉化為治療方法。
科學家在1929年發現ATP,當時全世界的研究人員正在找尋那難以捉摸的細胞能量來源,其中有兩個研究團隊幾乎是同時有了重大突破,分別是德國海德堡威廉大帝醫學研究中心的羅曼(Karl Lohmann)與1922年諾貝爾獎得主梅爾霍夫(Otto Meyerhof),以及美國哈佛大學醫學院的費斯克(Cyrus H. Fiske)和他的研究生蘇巴羅(Yellapragada SubbaRow)。他們發現,促使肌肉細胞收縮的胞內活動需要一種分子,是由某種嘌呤(即腺苷,為腺嘌呤鹼基加上一個核糖)和三個磷酸所構成。1935年,中國東北大連醫院的牧野堅提出了ATP分子的可能結構,該結構在10年後獲得英國劍橋大學化學實驗室的賴塞高(Basil Lythgoe)和陶德(Alexander R. Todd)證實。
在這段期間,沒有人想像過ATP在細胞外也扮演一角,即使到1962年仍是如此。當時本文作者勃恩史托克還是位年輕的神經生理學家,在澳洲墨爾本大學研究控制平滑肌的神經,他在探究自主神經系統(負責控制小腸和膀胱收縮等基本而需仰賴肌肉的功能)的訊號傳遞時,發現有些神經傳訊活動並未用到乙醯膽鹼或正腎上腺素等典型的神經傳遞物。由於1959年劍橋大學生理實驗室的霍頓(Pamela Holton)曾發表報告指出,感覺神經會釋放ATP,勃恩史托克對此感興趣,並開始測試運動神經和肌肉間的傳訊分子是否即為ATP。勃恩史托克展開一系列實驗,以化學物質阻斷傳訊到平滑肌的典型神經傳遞物,證明了存餘的神經訊號是由ATP遞送。勃恩史托克追蹤這條線索10餘年,到了1972年,終於有足夠信心提出以ATP為神經傳遞物的「嘌呤性神經」(purinergic nerve)的存在。
神經細胞產生的電脈衝會從神經元的一端傳到另一端,但這些電訊號並不能跨越神經細胞間微小的突觸間隙(synaptic cleft)或神經細胞與肌肉間的縫隙。細胞之間的訊號傳遞需要靠活化神經元將神經傳遞物釋放到間隙,這些化學分子(例如乙醯膽鹼、麩胺酸、多巴胺等)越過縫隙,與接收細胞上的受體蛋白質結合,引起細胞內部的一連串反應,改變了細胞的活性,讓接收訊號的神經元產生電脈衝,或是讓肌肉細胞收縮或放鬆。透過交錯的電脈衝和釋放化學分子,訊號得以在神經傳導線路上傳遞。
長久以來,科學家一直相信每個神經元只會製造一種神經傳遞物,並稱呼那些釋放乙醯膽鹼的神經元為乙醯膽鹼性神經元、釋放多巴胺的為多巴胺性神經元。勃恩史托克提出嘌呤性神經元概念的依據,除了他自己的觀察外,還有他在澳州墨爾本大學與英國倫敦的學生及合作同事的一系列初步研究,其中包括班奈特(Max Bennett)、坎貝爾(Graeme Campbell)、薩契爾(David Satchell)、霍爾曼(Mollie Holman)和藍德(Mike Rand)。
儘管有眾多證據顯示,神經元會釋放ATP到肌肉、腸和膀胱組織,但許多神經生理學家仍懷疑是否真有利用ATP傳訊的神經元。主要原因是他們很難相信,ATP這樣無所不在的分子,會執行如此特定的任務;再說,訊號分子要能發揮功能,則它的目標細胞上一定要有對應的受體。一直到1970年,科學家才找出第一個神經傳遞物受體,而找尋ATP受體的行動也跟著展開。
不過在尚未發現受體前,許多研究人員仍應用藥理學的方法,探討神經元釋出的ATP如何傳訊給肌肉或其他細胞。根據這些研究,勃恩史托克在1978年推測細胞可能有不同的受體家族,分別可辨識ATP和它的分解產物腺苷,並將前者稱為P2受體,後者稱為P1受體。進一步研究顯示,當ATP活化P2受體時,會產生不同的細胞效應,勃恩史托克和合作夥伴甘迺迪(Charles Kennedy)於是推測P2受體可能有兩種亞型,分別命名為P2X和P2Y。
作用效果,可長可短
人類基因組計畫在1990年代初期展開,科學家不斷找出人體內重要蛋白質的基因,其中包括幾個ATP受體基因,讓科學家得以檢查哪些類型的細胞上帶有這些受體,ATP訊號傳遞的研究於是進入全新且精采的紀元。科學家在分析嘌呤受體結構時,發現這是一支龐大的受體家族,他們還找到一些位於細胞表面、參與ATP訊號傳遞的離子通道和酵素。
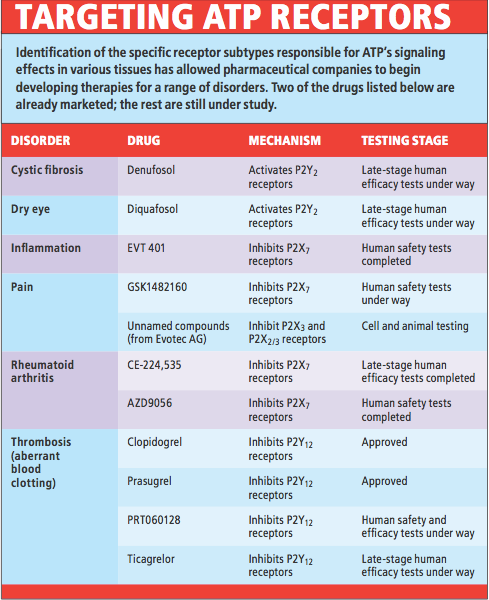
如同勃恩史托克的預測,科學家找到了兩類ATP受體,而這兩類受體含有的亞型則比原本預期的更多。受體的多樣化意味我們可以針對特定受體設計極具專一性的藥物,來調節某個組織或細胞的ATP訊號傳遞,現在這方面的研究正開花結果(參見上圖:targeting ATP receptors)。
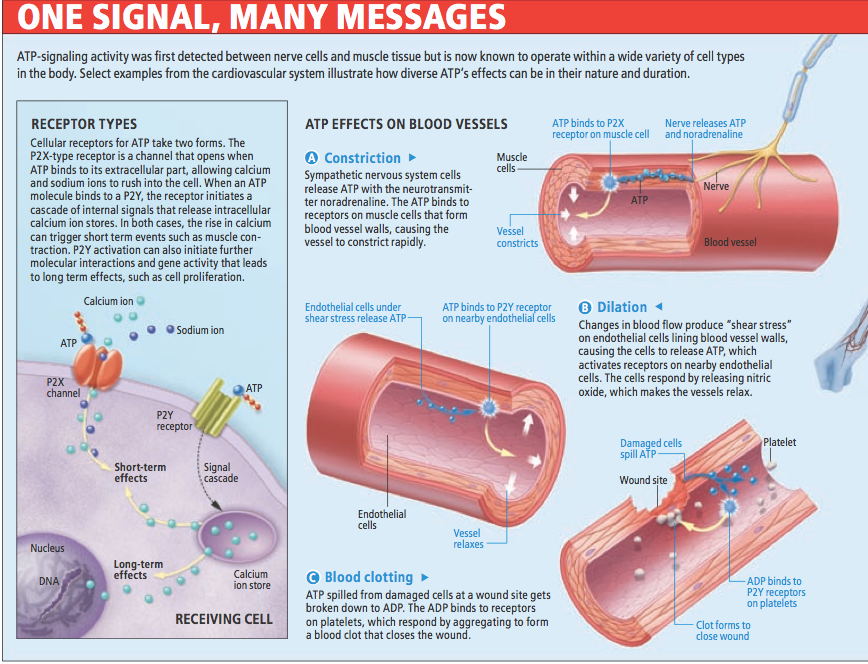
發現ATP受體後,多組研究團隊隨後發現,這兩類受體的作用機制完全不同。P2X受體屬於受神經傳遞物控制的離子通道家族,本文作者卡克和其他研究人員證實,P2X受體與ATP分子結合之後,會打開而形成通道,讓鈉離子和大量鈣離子湧入細胞。相對的,P2Y受體並不會形成通道,而是在ATP與受體的胞外構造結合後,引發細胞內一連串的分子交互作用,造成儲存在細胞胞器內的鈣離子釋放到細胞質中。無論是哪一種情況,細胞內增加的鈣離子都會啟動進一步分子反應,而改變細胞的行為。
ATP在突觸停留的時間很短,受體活化後所引發的細胞效應,可能短到在微秒之內就顯現,但也可能要長至數年後才看得出結果。舉例來說,如卡克在腦組織的研究中所見,經由P2X通道湧入細胞的鈣離子,會促使細胞釋出其他神經傳遞物;至於活化P2Y所釋出的鈣離子,則可能會改變細胞增殖基因的活性,導致組織變化,造成終生的影響。因此,儘管ATP在細胞外的作用時間短暫,它的生物效應卻可能延續很久。
若將ATP與細胞外其他訊號傳遞系統的交互作用納入考慮,ATP的機制就顯得更有趣了。大多數細胞表面都有「ectoATP酶」,這是龐大的酵素家族,它們會將ATP上的磷酸一個個切除,讓ATP一步步變成二磷酸腺苷(ADP)、單磷酸腺苷(AMP),最後成為腺苷。每一種分解產物都會對細胞產生不同的作用,像是腺苷會與P1受體結合。
舉例來說,日本東京慈惠會醫科大學的加籐總夫指出,在負責調控呼吸、心跳頻率以及腸胃蠕動等人體基本功能的腦幹中,ATP和腺苷的作用相輔相成。然而也有兩者互相拮抗的情況,例如神經元之間的訊號傳遞,腺苷會抑制神經元釋放ATP到突觸間隙。因此在許多狀況下,ATP、ATP組成單元以及細胞外ectoATP酶之間的交互作用,可說是形成了自我調節的訊號迴路。
不僅是ATP的分解產物會影響ATP分子對細胞的效應,其實在神經系統內,ATP也會扮演「輔助傳遞物」(co-transmitter)的角色,與其他神經傳遞物共同作用。這個現象是勃恩史托克在1976年發現的,它改變了科學家對於「任何神經元都只能合成、儲存和釋放單一種神經傳遞物」的觀念。現在有充份證據顯示,ATP經常伴隨正腎上腺素或乙醯膽鹼等典型神經傳遞物一同釋出;雖然輔助傳遞物的概念最早是因為研究ATP系統而提出並驗證的,科學家現在發現,其他系統也有輔助傳遞物,例如γ胺基丁酸(GABA)和甘胺酸、多巴胺和血清張力素、乙醯膽鹼和麩胺酸。因此,輔助傳遞物是另一個因為探討ATP傳訊而揭露一般生理學原理,並塑造且指引其他領域研究的範例。
利用ATP開發新藥物
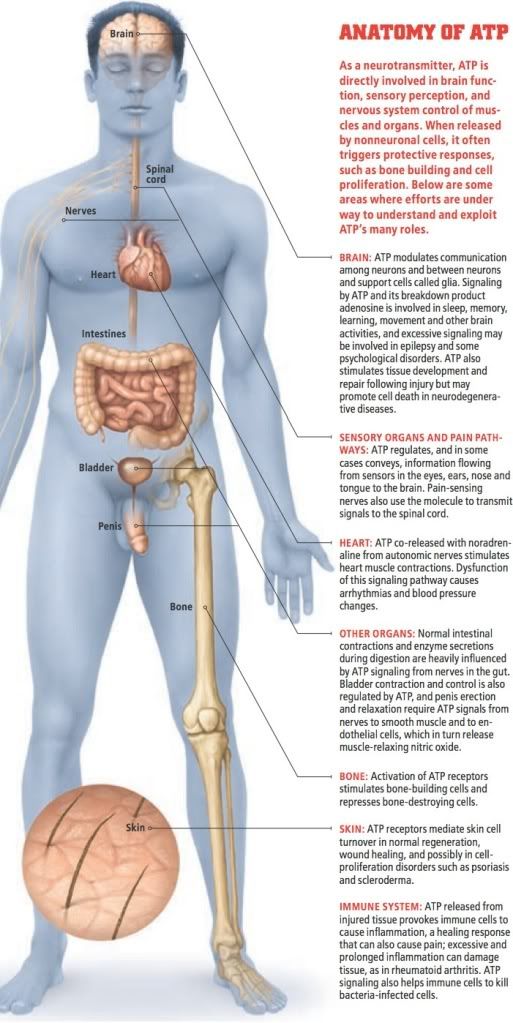
確立ATP在神經細胞之間的傳訊角色後,我們就不意外它在動物的五種感官知覺所擔任的重要功能。舉例來說,眼睛視網膜上感光的桿細胞和錐細胞傳送訊息給神經細胞時,神經細胞的ATP受體會影響細胞的反應,然後這些神經又會利用ATP和乙醯膽鹼,將資訊傳遞到腦部感覺處理中樞。除了參與生物體的日常功能外,幾個研究團隊指出,在胚胎眼睛發育關鍵時期的ATP訊號傳遞,也會造成一輩子的影響。事實上,英國瓦立克大學的戴爾(Nicholas Dale)和同事指出,在胚胎發育初期的某個關鍵時刻,ATP的釋出是眼睛發育的訊號。
聽覺系統要形成正確的耳蝸結構,發育期間也必須釋出ATP;即使到了成人,內耳的功能仍然仰賴ATP傳遞訊號。內耳的耳蝸裡約有五萬個負責傳遞聽覺資訊的毛細胞,在這些神經細胞中,大約一半帶有ATP受體,能幫助神經活化。此外,舌頭上負責味覺的感覺神經末稍:味蕾,也具有P2X受體。美國科羅拉多州立大學的金納曼(Sue C. Kinnamon)和同事以設計嚴謹的研究證實,ATP是味蕾細胞和味覺神經之間的重要訊號傳遞物;缺乏P2X2和P2X3受體的小鼠無法品嚐味道。
有趣的是,味蕾上發現的P2X2和P2X3受體,也和一些痛覺的傳訊有關。數十年來,科學家知道注射ATP到皮膚會引起疼痛,英國倫敦蓋氏國王聖湯姆斯生物醫學院的麥馬洪(Stephen B. McMahon)和同事最近指出,疼痛是皮膚內的觸覺和痛覺神經末稍上的P2X3受體活化所引發。另一種因神經受損導致的神經病理性疼痛,雖有不同的傳遞途徑,但也有ATP參與,日本九州大學的井上和秀與加拿大多倫多大學的沙爾特(Michael Salter)指出,會出現這類疼痛是因為脊髓內免疫性「微膠細胞」的ATP受體受到活化,然後微膠細胞會釋出刺激神經纖維的分子,最後導致慢性疼痛(參見科學人中文版2009年12月號〈慢性疼痛的幕後黑手〉或是我的簡介:Glia pain)。
瞭解ATP在訊號傳遞上扮演的角色後,數家藥廠開始研發以P2X受體為作用目標的藥物,希望能治療神經病理性或發炎引起的疼痛。針對ATP或其受體的療法將對人類健康有廣泛影響,紓解疼痛只是其中一個可能很快會獲益的層面。
ATP受體藥物的另一個受益者將會是心血管疾病患者,其理由在追蹤受傷的後續事件就明朗了:細胞在受損或壓力下會釋放ATP到胞外間隙,在這些狀況下,ATP通常會誘發保護和修復性的反應,包括活化血小板以形成血塊來阻止傷口出血。血小板上帶有P2Y12受體,當它與細胞外的ATP結合時,會引發血塊形成,然而當這個反應發生在血管內,血塊可能導致心臟病發作和中風。目前有一個非常成功的藥物clopidogrel,作用機制就是阻斷血小板上的P2Y12受體,使ATP無法促進血塊形成。有幾個功能類似的藥物現在正進行冠狀動脈心臟病療效的臨床測試。
消化系統也是ATP藥物可發揮效應的領域。美國密西根州立大學的賈利根(James J. Galligan)和其他研究人員證實,腸神經釋出的ATP會作用在腸壁肌肉細胞的P2X和P2Y受體,控制腸道的規律收縮而讓食物在腸內移動;ATP也會與消化道內壁細胞的P2Y受體結合,刺激細胞分泌消化酵素。因此,藥廠正積極找尋可作用於這些受體的藥物,以治療躁性大腸症候群和更嚴重的克隆氏病。
ATP還參與了其他器官和組織的運作,使它成為許多疾病的藥物作用目標,例如腎臟、骨骼、膀胱、皮膚和甚至神經與精神疾病。此外,ATP還可能是人體的天然抗癌工具。1983年,當時在美國波士頓大學醫學院的拉帕波特(Eliezer Rapaport)率先表示,他觀察到ATP能殺死腫瘤的效應。剛開始他也遭到質疑,但數個各別的研究團隊隨後皆證實ATP能抑制腫瘤生長,包括攝護腺癌、乳癌、結直腸癌、卵巢癌、食管癌,以及黑色素瘤。ATP訊號能促進腫瘤細胞自殺或細胞分化,從而減慢腫瘤細胞的繁殖。
我們還需要更多研究,才能將目前對ATP傳訊功能的認識,轉化成為可臨床使用的醫藥。但許多實驗室和藥廠都積極找尋能選擇性活化或阻斷特定ATP受體類型、增加或減少ATP釋出,或是抑制細胞外ATP分解的藥物。




 留言列表
留言列表
 線上藥物查詢
線上藥物查詢 