有關媒體報導中國大陸浙江華海製藥公司所生產高血壓治療藥品原料藥valsartan發現含「N-亞硝基二甲胺」(NDMA)成分,該成分具動物致癌性,對人類資料尚未證明,惟為確保民眾用藥安全,衛生福利部食品藥物管理署(以下簡稱食藥署)經清查所有該成分之製劑品許可證(共71項),發現其中有6項藥品使用該原料藥,分別為:
“生達”舒心樂膜衣錠 160 毫克、
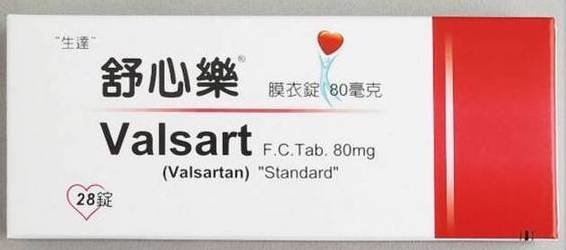
“生達”舒心樂膜衣錠 80 毫克、
"瑪科隆"科適壓膜衣錠80/12.5毫克、
"永信"樂速降膜衣錠160毫克、
"永信"樂速降膜衣錠80毫克及
凡內膜衣錠160毫克。

食藥署已於今(7)日要求業者啟動回收作業,通知醫療機構及藥局立即下架停止供應,並於1個月內(107年8月7日前)完成回收,請衛生局督導下架回收事宜,並請業者後續使用其他來源之原料藥。另提醒正在使用該等藥品的患者,該等藥品主要用於高血壓等需定期服藥控制之疾病,故不建議任意停藥,應盡速回診時,與醫師討論,處方其他適當藥品。
為確保藥物安全與醫療效能,食藥署已建置藥物安全監測機制,即時監視國內、外藥物安全訊息,除設有藥物不良反應通報系統及藥物不良品通報中心之外,並對於藥物之安全性與療效亦隨時進行再評估,如醫療人員或病患疑似因使用(服用)藥品導致不良反應之發生,請立即通報衛生福利部所建置之全國藥物不良反應通報中心,藥物不良反應通報專線02-2396-0100,網站:https://adr.fda.gov.tw。如發現藥物不良品時,請立即通報衛生福利部所建置之全國藥物不良品通報中心,藥物不良品通報專線02-6625-1166分機6401,網站: https://qms.fda.gov.tw。
CNN也有報導
召回涉及約2,300批, 傳送到德國, 挪威, 芬蘭, 瑞典, 匈牙利, 荷蘭, 奧地利, 愛爾蘭, 保加利亞, 義大利, 西班牙, 葡萄牙, 比利時, 法國, 波蘭, 克羅埃西亞, 立陶宛, 希臘, 加拿大 波斯尼亞和黑塞哥維那, 巴林和馬耳他.
https://edition.cnn.com/2018/07/06/health/valsartan-heart-drug-recall-intl/index.html
【發布日期:2018-07-09】 發布單位:食品藥物管理署企科組第四科(Tifsan)
一、於7月7日透過多重管道通知醫療機構及藥局下架,除要求業者於24小時內通知下游機構外,並透過健保VPN系統、衛生局及相關公協會轉知所轄機構或會員。
二、要求製劑業者於1個月內完成回收,並請各縣市衛生局於10日內查核轄內機構下架及回收情形。製劑業者於更換該原料藥來源前,不得生產。
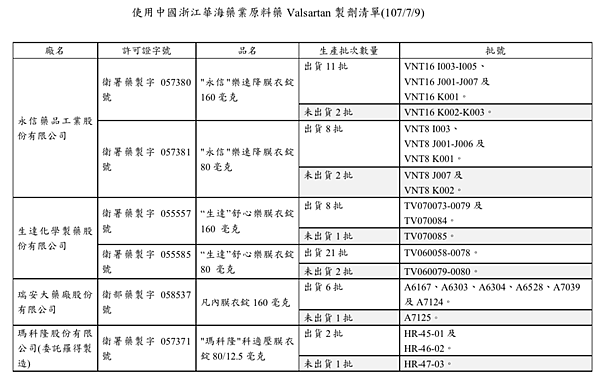
三、再次與業者交叉比對共生產65批;其中已出貨的56批應立即回收,未出貨9批禁止出貨(如附件清單)。
四、停止該原料藥之輸入及供應,要求原料藥輸入業者於1個月交付調查報告,說明該不純物(NDMA)之可能來源,並提出預防矯正措施,否則廢止其原料藥許可證。
為全面精進原料藥品質,落實源頭管理,食藥署自105年1月1日起,即要求製劑許可證應檢附原料藥符合藥品優良製造規範(GMP)之相關證明文件,並登錄原料藥來源(含廠名、廠址及國別),製劑藥廠亦負對於其原物料供應商之認可及監督責任。
食藥署持續依國際規範及我國對於藥品管理需求,精進藥事法之相關法規。同時建置藥品上市後安全及品質監測機制,即時監視國內、外藥物安全及品質訊息,進行調查及處理,以保障民眾用藥安全。




 留言列表
留言列表
 線上藥物查詢
線上藥物查詢 