
藥理作用
內生性副甲狀腺素可藉由將鈣質由骨頭釋出、經由腎臟將鈣質再吸收、間接促進腎臟合成活性維他命D等作用,來維持體內鈣質濃度之恆定。Teriparatide和內生性副甲狀腺素可結合在相同的接受器,因而對於骨頭和腎臟具有相同的生理活性。副甲狀腺素隨著投予方式不同,可能產生促進骨質形成(bone formation)或骨質再吸收(bone resorption)兩種不同作用,分別可增加或降低骨質密度。在動物實驗中發現, 每天投予一次
teriparatide,刺激骨母細胞作用會大於蝕骨細胞的作用,而促進小樑骨與皮質骨之骨質生成;在人體內,以低劑量(20μg)每日投予一次teriparatide,對於骨骼具有同化作用(anabolic effect),其機轉包括:刺激骨母細胞之活性、促進骨母細胞分化、防止成熟之骨母細胞凋亡(apoptosis)並延長存活期,進而增加骨母細胞之數目及功能,促進骨質生成,增加骨骼質量及骨骼強度。
相反地,若每日持續性輸注,產生類似副甲狀腺亢進(parathyroidism)之症狀,反而會刺激蝕骨細胞之活性,使得骨再吸收作用大於骨形成作用,進而影響骨質密度。
藥動學特性
Teriparatide 以皮下注射後吸收良好,生體可用率約為95 %,血中濃度會隨著投予劑量增加而呈線性上升,皮下注射後,30分鐘達到最高血中濃度,排除半衰期為1小時,在2~3小時後降低至無法定量之濃度,為一吸收快速且排除快速之藥物,每日投與並無藥物蓄積之情形。
Teriparatide的全身清除率在女性為62升/小時,男性為94升/小時,顯示有肝臟及肝臟以外之清除作用。皮下注射後分布體積為1.7升/公斤。Teriparatide在輕度至中度腎功能不全之病人(Clcr 30-72 ml/min)以單劑量
投予後,其藥動學和腎功能正常者並無差異,因此不需進行劑量調整。在嚴重腎功能不全之病人(Clcr < 30 ml/min),曲線下面積及半衰期分別增加73 %及77 %,最高血中濃度則不變,目前並無劑量調整之建議
臨床療效及適應症
在1673名有脊椎骨折病史之停經後婦女所進行之隨機雙盲、安慰劑對照臨床試驗,每日分別以皮下注射投予20 μg、40 μg之teriparatide或安慰劑,平均治療時間為18個月,研究期間所有病患僅能補充鈣質及維生素D,無併用其它影響骨骼代謝之藥品。研究結果中,在骨質密度方面,相較於對照組, teriparatide 投予20μg或40 μg,分別可增加腰稚骨(lumbarspine)之骨質密度9.7 %及13.7 %,另外在髖骨(hip)、股骨頸(femoral neck)
及全身之骨質密度之增加,相較於對照組皆有統計上之意義。在骨折風險方面,相較於對照組,投予eriparatide 20 μg或40μg,在新脊椎骨折分別可降低65 %及69%之相對風險,在非脊椎之新骨折分別可降低35 %及40 %之相對風險。和其他抗蝕骨作用劑在相似族群之研究結果比較起來,teriparatide不論在脊椎或非脊椎之
新骨折皆有較高的相對風險之降低率;以新脊椎骨折而言,alendronate(10 mg/天)可降低48 %之相對風險,raloxifene(60mg/天)可降低30 %之相對風險。以非脊椎之新骨折而言,alendronate可降低20 %
之相對風險,raloxifene僅可降低10 %之相對風險4 。進一步分析發現, 使用teriparatide治療後所觀察到之療效和病患之年齡、治療前之骨質密度以及治療前脊椎骨骨折之數目無關。
對於原發性或性腺功能低下之男性骨質疏鬆症病患,在進行隨機雙盲、安慰劑對照臨床試驗後,也證實具有臨床效益,研究中每日分別以皮下注射20 μg、40 μg之teriparatide或安慰劑,最長治療時間為14個月,在治療3個月後進行評估,發現投予20 μg及40 μg,可分別增加腰椎骨之骨質密度5.9 %及9.0 %。
目前teriparatide在衛生署核准之適應症,主要是停經後婦女骨質疏鬆症具高度骨折風險者,以及男性原發性或次發性的腺功能低下之骨質疏鬆症且具高度骨折風險者。在健保給付規範方面,自94年5月1日起修正施行之給付規定為:用於因嚴重骨質疏鬆症而造成二個(含)以上脊椎或一個髖骨骨折之患者、使用期限不得逾18個月、以X光或DXA形態測定時,應將壓迫性程度記錄於報告中、不得併用biphosphonates、calcitonin、raloxifene及活性維生素D3等藥物。
藥物不良反應
使用teriparatide治療期間常見之副作用包括噁心、頭痛、暈眩、關節痛、腿部痙攣等,副作用之發生率和劑量有關,在臨床試驗中曾發現,噁心及頭痛是最常造成病患無法繼續接受治療的原因。有些病患在前幾次開始治療時,給藥後4小時以內,可能會出現暫時性姿勢性低血壓,此症狀一般會在數分鐘至數小時內自行緩解且不影響療程之進行,為避免此暫時性低血壓之症狀,建議注射藥品時可讓病患採坐姿或臥姿來緩解。病患可能會有血中尿酸上升之情形,但並不具有臨床意義。
Teriparatide對血鈣之影響在不同臨床試驗中所觀察到之結果並不一致,雖然許多報告指出teriparatide會使血鈣上升,但有些並未超過正常值之上限,另有報告則指出血鈣值不變或下降,血鈣上升可能和投予劑量有關。一般在給藥後約2小時,血鈣會暫時性上升,4~6小時達到最高濃度( 血鈣上升之中位數為0.4mg/dL),16 ~ 24小時後恢復到給藥前之血鈣值,目前在臨床試驗中並無觀察到持續性高鈣血症之情形,若一旦發現應立即停藥,並評估引起高鈣血症之原因,若病患在治療前已診斷出有可能造成高鈣血症之疾病,不建議使用teriparatide
警語及注意事項
在動物試驗中,觀察到teriparatide會造成老鼠罹患骨肉瘤(osteosarcomas)之發生率增加,推測可能和使用劑量及治療時間有關,雖然在人體臨床試驗中並未發現有骨肉瘤之案例,但藥廠仍提出警示,在治療前若有罹患骨肉瘤之危險性的病患,例如患有Paget’s disease、不明原因之鹼性磷酸酶(alkaline phosphatase)增
加、兒童或青少年伴隨有開放性骨垢板(open epiphyses)、曾接受過涵蓋骨骼的放射線治療等,皆不可使用teriparatide。此外,患有骨質疏鬆症以外之其他代謝性骨骼疾病、轉移性骨癌或骨惡性腫瘤等病患,也應避免使用teriparatide。由於藥品上市前之臨床試驗並未有2年以上之療效及安全性評估, 因此不建議使用teriparatide超過2年。
建議劑量及使用須知
Teriparatide在臨床試驗中所使用的劑量20μg及40μg,雖然投予40μg所增加的骨質密度高於20μg,但兩種劑量對於骨折危險性之降低有相似之療效,投予40μg反而具有較高之副作用,4因此,目前teriparatide之建議劑量為每天皮下注射20μg一次3。在起始作用(onset)方面,男女性骨質疏鬆症患者,以20μg之劑量每天皮下注射一次,連續治療三個月後,即可觀察到腰椎骨之骨質密度有顯著之上升。
Teriparatide充填於注射筆中,藥品含量為750μg/3 ml,皮下注射於大腿或腹部,每次投予皆需更換新的注射針頭。Teriparatide須於2 ~ 8℃冷藏存放,不可將藥品冷凍。藥品外觀為澄清無色液體,若出現顆粒、混濁或變色皆不可使用。每支注射筆可連續使用28天,超過28天仍未使用完之藥品應丟棄不可再使用
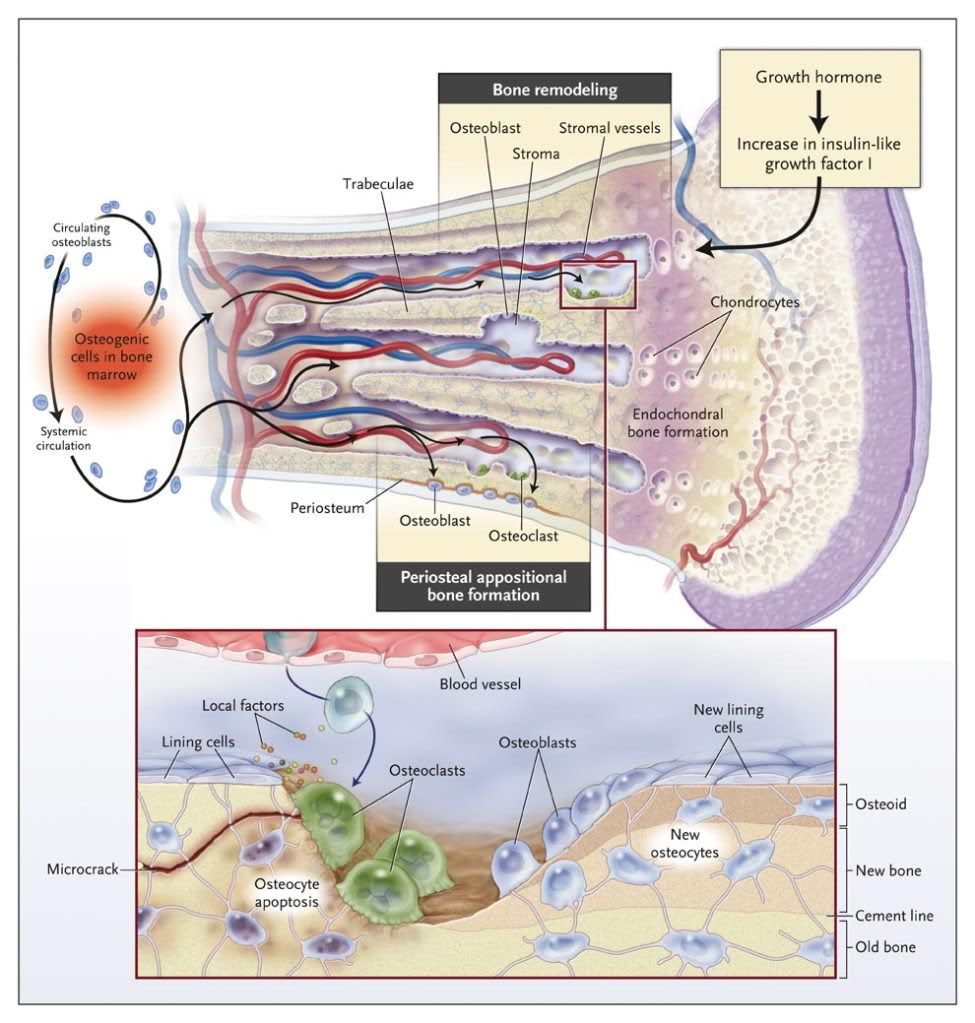
Bone Remodeling in Basic Multicellular Units and Bone Modeling by Osteoblasts and Osteoclasts.
During growth, chondrocytes mature and direct the formation of new bone trabeculae in the process of endochondral bone formation,
and osteoblasts form new bone by periosteal appositional growth. These processes determine the length and width of bones. Bone is
remodeled by osteoclasts (bone-resorbing cells) coupled with osteoblasts (bone-forming cells) in basic multicellular units. Bone remodeling
is necessary to maintain calcium homeostasis and to renew bone to repair microdamage and microcracks. The shape of bone is
determined by the modeling conducted by uncoupled osteoblasts and osteoclasts.
Canalis et al. 357 (9): 905, Figure 1 August 30, 2007
訪單資訊:http://www.lilly.com.tw/public/new/world/Chinese%20User%20Manual.pdf
http://www.lilly.com.tw/public/new/world/Forteo%20Nov2007.pdf
相關連結:http://blog.pixnet.net/mulicia/post/4013585
關鍵字: Teriparatide forteo




 留言列表
留言列表
 線上藥物查詢
線上藥物查詢 