膠細胞是神經細胞的守護者,但它們有時也可能呵護過度。 要紓解現有藥物無法平息的疼痛,或許可從控制膠細胞著手。
原理說明圖解

最新研究終於釐清了傳統止痛藥經常無法紓解神經病理性疼痛的原因:止痛藥的作用目標是神經元,而慢性疼痛的禍首卻可能是位於腦和脊髓中稱為膠細胞(glia cell)的非神經細胞。科學家了解這些維持神經元活動的膠細胞,也可能失衡而擾亂神經功能後,也有了治療慢性疾病的靈感,這些研究還提供了突破性的觀點,能解決疼痛患者對麻醉藥成癮的後果。
阻斷痛覺傳遞的路徑
要了解為什麼疼痛在傷口癒合後仍然持續,必須先知道疼痛的成因。雖然解讀受傷疼痛感覺的是大腦,但發出疼痛訊息的卻是在脊髓內、收集全身感覺資訊的神經細胞。人體的痛覺傳遞可分成三個階段,第一階段由背根神經節(dorsal root ganglion, DRG)細胞傳遞,這些細胞的本體聚集在從尾骨到頭顱間每塊脊椎骨旁的縫隙裡,形成一顆顆的節狀構造,宛如外套上的兩排鈕釦。每個DRG細胞都有兩條向外伸出的分支,一條是具有細長分支的感覺受器,會伸向不遠的部位探查,稱為軸突(神經纖維);另一條分支則伸入脊髓內,接觸在第二階段傳遞神經衝動的脊髓神經元,這些脊髓神經元再將來自DRG細胞的訊息轉送到最終目的地:腦幹和大腦皮質。來自身體左側的痛覺訊息會在脊髓內交叉傳到右腦,身體右側的訊息則傳到左腦。
阻斷痛覺線路上任何一個階段的訊息傳遞,都能減輕疼痛。牙醫拔牙時使用的局部麻醉劑奴佛卡因(Novocain),會讓注射部位的神經纖維麻木,阻止細胞送出電脈衝;分娩時使用的「脊髓阻斷」麻醉,則是干擾痛覺線路的第二階段:DRG軸突束與脊髓神經元接觸點的訊息傳遞,這種阻斷作用讓母親能在無痛但意識清醒的情況下分娩。在同一位置注射嗎啡也能降低脊髓神經元的痛覺傳遞,卻完整保持了非痛覺知覺。重大手術使用的全身性麻醉劑則會阻斷大腦皮質的資訊處理機制,讓患者失去所有從腦部外面傳來的感覺。
人體內的天然止痛劑同樣也作用於痛覺線路的三個環節。一名腎上腺素大量分泌的戰士可能身受重傷而渾然不覺,因為他的大腦正忙著處理威脅生命的緊張狀況,而忽略了痛覺訊號。自然分娩的女性身體會分泌腦內啡(endorphin),這種小型蛋白質分子可阻止痛覺訊息進入脊髓。激素、情緒及其他許多因素都可以影響痛覺的傳遞,改變人對於痛覺的感受。還有許多生物機制和分子會調節神經細胞上讓分子進入或流出的離子通道,同樣也會影響神經的敏感度。當身體受傷時,這些因子可減輕對神經活化的控制,有助於神經元傳遞痛覺訊息。
然而這種未受抑制的狀態也可能持續過久,使得DRG細胞太敏感,在沒有外來刺激時仍發出痛覺訊息,這就是神經病理性疼痛的主要原因。神經敏感度增加還會引起刺痛、灼熱、搔癢和麻木等異常感覺,就像海倫覺得洗澡水刺如利刃,輕微碰觸或溫度感覺被強化放大到難以忍受的程度,這種現象稱為異位疼痛(allodynia)。
長久以來,科學家試圖釐清人體受傷後為什麼痛覺傳遞線路上的神經元會過度敏感時,不難想像他們的焦點全都集中在神經元,這些研究雖然提供了一些線索,卻拼湊不出完整的面貌。舉例來說,我和許多同事證明,傳遞痛覺訊息的神經脈衝會改變痛覺神經元基因的活性。這些受神經活化而調控的基因又會製造出離子通道和其他讓細胞更敏感的物質。因此當組織受損時,DRG細胞的激烈活化可能會改變細胞的敏感度,進而引發神經病理性疼痛。不過我們和其他實驗室的研究也顯示,神經元不是唯一會對受傷反應,並釋出增加神經敏感度分子的細胞。
在脊髓和腦部,膠細胞的數目遠超過神經元。膠細胞雖不會送出電脈衝,卻擁有一些有趣且重要的性質,能影響神經元的活動。膠細胞負責維持神經元周圍的化學環境,除了運送神經細胞需要的能量外,也會清除神經元對鄰近神經元發送訊息時使用的神經傳遞物(neurotransmitter),有時甚至還會釋出神經傳遞物來增強或減弱神經傳送的訊息。神經元受傷時,膠細胞會釋出生長因子來幫助神經元的存活和復原,也會分泌一些物質,召集免疫細胞來協助對抗感染和啟動修復機制。然而最新研究卻指出,膠細胞對神經元的滋養和協助神經訊息的傳遞,也會延長神經的敏感的程度。
接下來,當然就是跟藥師最相關的藥物問題啦
膠細胞成為嫌疑犯
科學家在100多年前就知道膠細胞在受傷時會有反應。1894年,德國人尼梭(Franz Nissl)發現當神經受傷時,位於神經纖維和脊椎或腦接觸點附近的膠細胞會有明顯的改變:微膠細胞(microglia)數目增加,而另一種體型較大的星狀細胞(astrocyte,因細胞本體呈星狀而得名)會變得更大,而且細胞內出現了可強化細胞骨架的粗大絲狀纖維束。
一般認為,膠細胞的反應是為了促進神經的修復,但對如何促進修復並不清楚,再說受傷的位置如果離脊髓痛覺傳遞線路很遠(例如腳踝扭傷),脊髓星狀細胞的反應必定不是直接針對受傷組織,而是要改變DRG細胞和脊髓神經元接觸點的訊息傳遞。這個現象意味著,星狀細胞和微膠細胞會監控痛覺神經元的生理特性。
過去20年來,科學家發現膠細胞具有許多用來偵測神經元電活動的機制,像是細胞膜上有離子通道可感應神經元發出電脈衝時流出的鉀離子和其他離子;一些表面受體可偵測神經元在突觸訊息傳遞時使用的神經傳遞物(例如麩胺酸、ATP和一氧化氮等)。這些多樣化的偵測器,讓膠細胞得以監控全身與腦部神經線路的電活性,並視生理狀況而應變(請參見台灣版科學人2004年5月號〈魅影腦細胞〉)。關於ATP,也可以參考:雙面 ATP (The double life of ATP)
科學家瞭解膠細胞的反應對神經活動影響深遠後,就開始注意這些輔助細胞在痛覺傳遞接點的可疑行為。如果膠細胞會監視傳遞痛覺訊息的神經,是不是也會控制這些細胞呢?在尼梭觀察到神經受傷時膠細胞反應的整整100年後,科學家進行了一個簡單的實驗,首次測試膠細胞是否與慢性疼痛有關。1994年,美國愛荷華大學的梅勒(Stephen T. Meller)和同事將一些毒素注射到大鼠體內,這些毒素只會殺死星狀細胞,接著科學家測試動物的痛覺敏感度是否會降低,結果大鼠痛覺敏感度正常,顯示星狀細胞並沒有參與急性疼痛的訊息傳遞。
然後科學家給動物施以神經纖維刺激物,讓大鼠產生慢性疼痛,這種情況類似海倫在車禍很久之後仍受腳踝神經刺激所苦,結果之前注射了星狀細胞毒素的大鼠,慢性疼痛明顯較少,代表星狀細胞與神經受損後慢性疼痛的形成有關,而後續研究揭露了其中機制。
膠細胞會釋放出多種分子,例如生長因子和神經傳遞物,讓負責傳遞痛覺訊息到腦部的DRG和脊髓神經元的敏感度增加。科學家漸漸瞭解到,膠細胞會把神經元快速活化和活化所誘導的改變,詮釋成神經元正承受巨大壓力,於是膠細胞釋出讓神經元敏感度提高的分子,透過幫助神經元傳遞訊息來紓緩神經細胞的壓力,並開始復原。
在膠細胞因應神經損傷或壓力而分泌的物質之中,有一類重要的分子稱為細胞素(cytokine,為cytokinetic的縮減寫法,原意為「細胞的移動」)。細胞素有如強大的化學信號燈,可吸引免疫系統的細胞來到傷口。想像你的指尖不小心被木屑刺傷了,免疫細胞要找到傷口,就像大海撈針,然而有了受傷細胞釋出的強效細胞素,血液和淋巴內的免疫細胞就能趕到受傷的指尖來對抗感染,並啟動修復程序。細胞素還會引發組織和傷口週遭的血管改變,讓免疫細胞容易進行任務,並利於癒合,不過這些改變也會造成傷口紅腫。細胞素信號造成的整體效應即為發炎。
從皮膚的小刺傷,可以看出細胞素動員免疫細胞到傷口的效率,但更令人印象深刻的是這樣微小的傷口竟然會如此的痛,組織損傷的規模和它引起的疼痛,完全不成比例。沒多久,即使鄰近的皮膚細胞並沒有受傷,也會腫了起來,而且一碰就痛。這種痛覺敏感是發炎反應的另一個效應:痛覺纖維的敏感度大幅增加。傷口附近痛覺受器變得過度敏感,是要讓我們知道別碰這個地方,好讓它能夠癒合。
在神經系統內,細胞素通常不是由神經元釋放,而是膠細胞。就像指尖刺傷部位的神經末稍會因細胞素變得非常敏感,脊髓膠細胞在因應強烈痛覺訊息時釋出的細胞素,也會讓鄰近的神經纖維過度敏感,然後形成了循環:過度敏感的神經元激烈活動,讓更多膠細胞進入反應狀態,釋放出更多促進敏感的因子和細胞素,企圖減少神經元的壓力,結果反而使壓力持續下去。當這種情況發生時,疼痛可能來自脊髓內沒有直接受到損傷的神經纖維。
膠細胞一開始的反應有益於損傷的修復,但當反應太強或持續太久,就會造成無法停止的慢性疼痛。數個研究團隊證明,反饋迴路造成膠細胞釋放促進敏感因子和發炎信號的時間過長,導致神經病理性疼痛。許多團隊正在試驗能逆轉這個過程的方法,這些研究結果能應用於急性疼痛的治療,增強麻醉劑的效力。
終止疼痛的惡性循環
以往慢性疼痛的治療目標都是降低神經元的活性,但只要膠細胞繼續刺激神經細胞,疼痛就不可能停止。瞭解膠細胞如何落入神經敏感的惡性循環,可能為終止神經病理性疼痛找到新方法:調控失常的膠細胞。因此,目前治療神經病理性疼痛的試驗都著重於讓膠細胞穩定下來,阻斷髮炎刺激因子和信號,或是給予消炎信號。
舉例來說,美國達特茅斯醫學院的迪里歐(Joyce A. DeLeo)和同事利用動物實驗,證實丙戊茶鹼(propentofylline)可抑制星狀細胞活化而紓緩慢性疼痛。抗生素米諾環素(minocycline)可防止神經元和膠細胞製造發炎性細胞素和一氧化氮,也能減少移動到受傷部位的微膠細胞,顯示藥物可防止膠細胞過度活化。
還有個相關辦法則是針對類鐸受體(TLR),這種位於細胞膜上的蛋白質可偵測細胞處於壓力狀態下的特定信號,而促使膠細胞釋出細胞素。美國科羅拉多大學波爾德分校的華金斯(Linda R. Watkins)和同事,利用會阻斷TLR-4的實驗藥物處理動物的脊髓膠細胞,結果讓源自坐骨神經損傷的神經病理性疼痛停止。有趣的是,在治療毒癮時使用的鴉片類麻醉藥拮抗劑納洛酮(naloxone),作用機制也是阻斷膠細胞TLR-4的活化。華金斯利用大鼠實驗證明,納洛酮可治療神經病理性疼痛。
大麻是歷史悠久的止痛藥,在其他止痛藥都失效時,往往仍能發揮作用。美國有幾州已將藥用大麻合法化。大麻含有一些化合物可模擬大腦裡天然的大麻素(cannabinoid),活化神經元上的特定受體,並調節神經訊號的傳遞。
大腦和神經系統裡存在著兩種大麻素受體:CB1和CB2,各有不同的功能。活化CB2受體可紓解痛覺,而活化CB1受體則會誘發大麻的精神刺激效應。有趣的是,可紓解痛覺的CB2受體不在神經元上,而是位於膠細胞。當大麻素與微膠細胞上的CB2結合時,會減少微膠細胞送出的發炎信號。最新研究發現,當慢性疼痛形成時,微膠細胞上的CB2受體會增加,暗示細胞正奮力捕捉附近更多的大麻素來紓解疼痛。現在藥廠正積極開發作用在膠細胞CB2受體、但不會造成亢奮的藥劑。
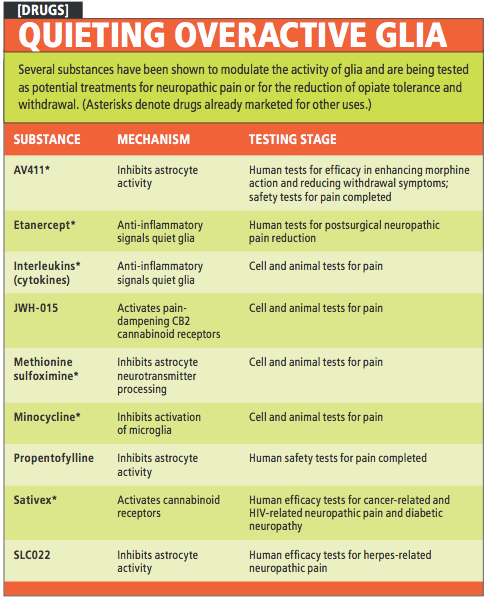
利用anakinra(商品名Kineret)和益賽普(etanercept,商品名Enbrel)等現有的消炎藥來阻斷髮炎性細胞素,在動物實驗中也能降低神經病理性疼痛。除了阻斷髮炎信號外,有數個研究團隊證明,增加消炎性細胞素,例如介白素-10(IL-10)和介白素-2(IL-2),也能抑制動物的神經病理性疼痛。丙戊茶鹼和AV411兩種藥物皆能刺激細胞製造IL-10而抑制發炎。此外,有多個研究團隊將IL-10和IL-2基因送入動物的肌肉或脊髓,而能減緩神經病理性疼痛達四星期之久。
目前有幾種止痛藥已進入人類臨床試驗(參見右頁〈安撫過度活化的膠細胞〉),其中包括了在日本用來治療中風發炎現象的AV411。而在澳洲進行疼痛治療的臨床試驗中,接受AV411的受試者自願降低嗎啡的使用量,顯示藥物能紓解疼痛。但AV411的作用可能不只是平息發炎引起的疼痛,還點出了膠細胞與疼痛之間意外的發展。
恢復神經活性的平衡
嗎啡是已知效力最強的止痛劑,但由於嗎啡帶有邪惡的特質,醫生在使用時都小心翼翼,即使在治療癌症末期病患時都非常謹慎。嗎啡和海洛因、鴉片及現代麻醉劑(例如奧斯康定)一樣,會抑制脊髓神經元之間的傳訊,透過阻止痛覺訊息傳遞來減輕疼痛。
不幸的是,嗎啡和其他麻醉劑連續使用後,很快就失去效用,這種特性稱為耐受性(tolerance),患者必須不斷提高劑量和用藥頻率才能達到相同的效果。慢性疼痛病患可能因此上癮,疼痛再加上讓人越陷越深的依賴性,使得問題雪上加霜。醫生害怕若是開給病患大量麻醉劑,會被質疑為販毒,因此限制病患的劑量,但有時卻已經完全無法紓緩疼痛。有些病患只得鋌而走險,以非法藥物來減輕難耐的疼痛,甚至有些患者選擇以自殺來結束苦難。有一項新證據顯示,膠細胞與海洛因和嗎啡的耐受性有關,而串起了止痛、膠細胞和藥物成癮的關係。
【欲閱讀更豐富內容,請參閱台灣版科學人2009年第94期12月號】




 留言列表
留言列表
 線上藥物查詢
線上藥物查詢 