續上篇一樣附上影片
10

--------------------------------------------------------------
11

--------------------------------------------------------------
12
--------------------------------------------------------------
13

--------------------------------------------------------------
14
--------------------------------------------------------------
15
--------------------------------------------------------------
16

--------------------------------------------------------------
17

--------------------------------------------------------------
18
--------------------------------------------------------------
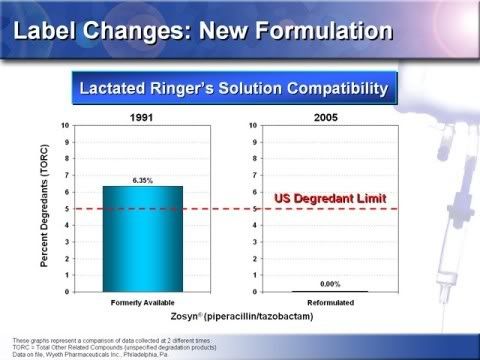
19
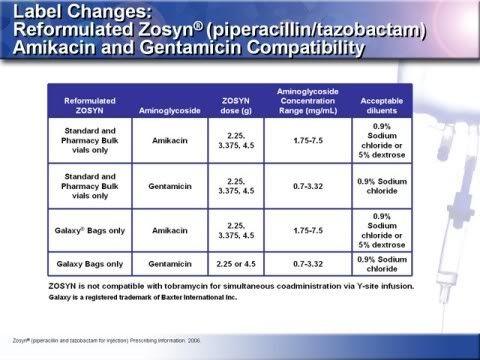
--------------------------------------------------------------
20
--------------------------------------------------------------
21

--------------------------------------------------------------
22

--------------------------------------------------------------
23

10

10.下一階段將探討之前所談論到有關微粒物質原則之應用,以及探討影響溶液微粒多寡的變化,這個案例說明了重新製造Tazocin (Piperacillin and Tazobactam) 的年代大事紀要。
--------------------------------------------------------------
11

11.惠氏藥廠在常規的產品檢測中發現,臨床上常用的藥劑混合系統偶而會發現有過量的微粒物質產生,並分析微粒物質產生之根本原因,在此期間惠氏藥廠移除橡皮塞所含之矽膠(silicone),並將效期由36個月縮短為24個月,以達到USP788的標準,然而,產品仍偶而無法通過微粒物質檢測。
--------------------------------------------------------------
12

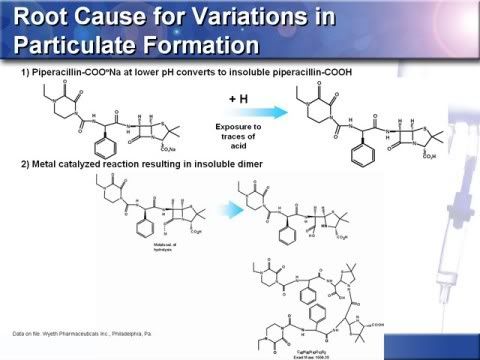
12.以下反應式在根本原因分析中說明了舊的Tazocin (Piperacillin and Tazobactam)之微粒物質產生的機轉,第1個反應式證實微酸環境中分子可溶性下降促使微粒產生,而新的Tazocin 對市售稀釋液之微酸環境則具有耐受性;在第2個反應式中,金屬鋅離子能穩定開啟的環狀結構,由於鋅離子扮演的是催化劑所以並不會耗盡,能不斷的促進反應進行,導致不可溶的二聚體(dimer)形成。
--------------------------------------------------------------
13

13.溶液的穩定性受PH值及金屬離子所影響,低PH值的稀釋液會降低可溶性而增加微粒物質產生,piperacillin的化學降解不僅可能會減少效價,也會增加藥物降解物相關之微粒物質產生,低PH值會增加從輸液管路、包裝袋、隔膜、橡皮塞等接觸面分離出金屬離子,特別是鋅離子會提高piperacillin結構中beta-lactam環的開啟而增加高度不可溶的二聚體形成促使微粒產生。
--------------------------------------------------------------
14

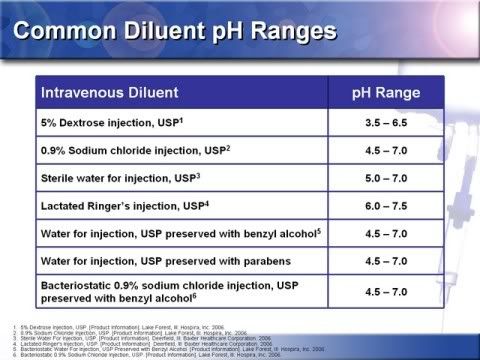
14.惠氏(Wyeth)藥廠檢視分析大量市售稀釋液,發現常用於回溶注射藥物的稀釋液有很大的PH值變異,5%右旋醣注射液的PH值可低到3.5高到6.5,即使PH值較為中性的乳酸林格氏液(lactated ringer’s solution)也有相同情形。
--------------------------------------------------------------
15

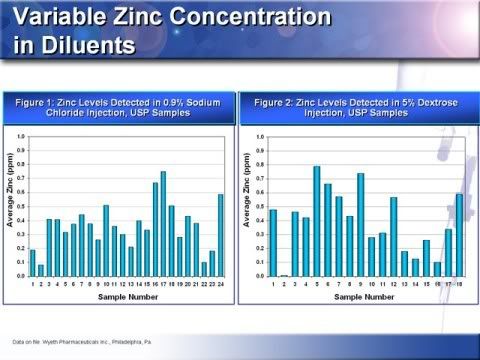
15.採樣顯示常用的稀釋液中鋅濃度的精確度測試(intra and interbatch)差異也很大,圖表1顯示0.9%的生理食鹽水有很大的鋅濃度ppm差異,可以低到0.01ppm或是超過0.7 ppm,圖表2顯示5%右旋醣注射液之鋅濃度檢測,儘管都來自同一家製造商一樣有從0.1ppm到0.8 ppm的差異,這是很好的例子,而目前市面IV輸液及常用的稀釋液也有這樣的鋅濃度差異。
--------------------------------------------------------------
16

16.一般常用稀釋液的鋅濃度差異也頗大,高濃度鋅及低PH值環境造成的不相容,會產生非預期的降解產物及過量的微粒數量。
--------------------------------------------------------------
17

17.舊的Tazocin 由於金屬離子及稀釋液的PH值變化而無法達到USP788標準,重新製造的Tazocin 加入緩衝劑檸檬酸來控制PH值及螯合劑EDTA來移除金屬離子,新製造的Tazocin改善了市售混合稀釋液失控的PH值變化以及含有金屬離子所導致的微粒產生。
--------------------------------------------------------------
18

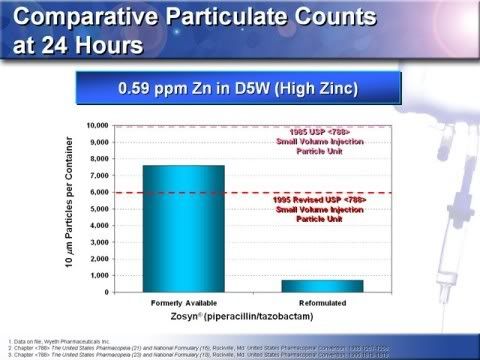
18.這項研究顯示,Tazocin (Piperacillin and Tazobactam)加上檸檬酸及EDTA能降低微粒的產生,試驗中分析不同IV包裝袋所含之鋅濃度,在含有0.59 ppm鋅高濃度鋅包裝袋的比較結果顯示,新舊製程的Tazocin 在24小時 ≧10μM微粒物質濃度的比較有顯著的差異,舊製程的Tazocin証實有較多的7600個 ≧10μM微粒物質,然而新製的Tazocin 只有700個 ≧10μM微粒物質。
--------------------------------------------------------------
19

19.藉由測量其非特異性降解產物(TORC)以比較新與舊的Tazocin 以乳酸林格氏液回溶達到微粒物質標準的相容性,如圖所示,舊的Tazocin 室溫下第一天平均6.345%的TORC相較於新製的Tazocin 0.00 %的TORC而言,是無法通過微粒物質的標準。美國對降解物的限制是5%,基於這項發現,舊的Tazocin並不適合以乳酸林格氏液回溶,而新製的Tazocin 0.00 %的TORC則明顯相容於乳酸林格氏液,新製的Tazocin 有較少的24小時非特異性降解產物,就USP降解物標準來比較新舊配方的Tazocin 在乳酸林格氏液中不管是TORC或降解產物都證實具有差異。
--------------------------------------------------------------
20

20.新配方的Tazocin也提高了與胺基醣苷類抗生素(aminoglycosides)的相容性,表格中Amikacin抗生素濃度是以每天每公斤體重10-15 mg每日2劑,Gentamicin則是以每天每公斤體重3-5 mg每日3劑,而Tazocin含EDTA經由Y-site給藥未被評估,關於aminoglycosides的劑量及處方介紹請看完整的處方資訊,由於Galaxy bags 包裝之3.375 g / 50ml Tazocin濃度較高,並不適合經Y-site合併Gentamicin給藥,Tazocin 與Amikacin併用之標準稀釋體積是50 ml、100 ml以及150 ml,與Gentamicin併用之標準稀釋體積則是100 ml以及150 ml。
--------------------------------------------------------------
21

21.新配方的Tazocin 持續改善品質達到USP788的標準,對臨床使用之市售稀釋液PH值有較佳的耐受性能減少微粒產生,並能抑制臨床使用之市售稀釋液中金屬離子污染所催化的化學降解及微粒產生,新製的Tazocin也改善了舊配方與Amikacin 及Gentamicin原先之不相容性,在某些情況下可以與乳酸林格氏液及常用之靜脈輸液合併使用,而舊製的Tazocin 由於超過美國TORC的限制則顯示不相容。
--------------------------------------------------------------
22

22.Tazocin 的適應症包括:*piperacillin抗藥性葡萄球菌引起之中至重度院內感染肺炎(nosocomial pneumonia)、對piperacillin/tazobactam敏感之鮑氏不動桿菌(Acinetobacter baumannii)、流感嗜血桿菌(Haemophilus influenzae)、克雷白氏肺炎菌(Klebsiella pneumoniae)以及綠膿桿菌(Pseudomonas aeruginosa)感染。*以Tazocin治療綠膿桿菌引起之院內感染肺炎之起始劑量應為4.5g / 6小時,並應合併一種aminoglycoside同時治療,若未檢出綠膿桿菌則主治醫師可考慮停用aminoglycoside。*由於Tazocin 是piperacillin藥物,因此能有效治療對於piperacillin敏感之有機體感染,如論如何,處方前請詳閱完整處方資訊。
--------------------------------------------------------------
23

23.*Tazocin與tobramycin不適合經由Y-site同時給予,目前只確立與amikacin 及gentamicin 可經Y-site同時給藥,Tazocin 與其他胺基醣苷類(aminoglycosides)抗生素的相容性尚未建立,只有濃縮或稀釋之amikacin 或 gentamicin與此處所列之Tazocin劑量已確立可經Y-site同時給藥,除了在此列出之外的任何形式以Y-site同時給藥可能會導致胺基醣苷類抗生素去活化。* 對於penicillins、 cephalosporins或 beta-lactamase 抑制劑有過敏反應之病患禁用Tazocin。*應仔細詢問病患之前對藥物的過敏病史、嚴重度、中毒反應、休克以及是否曾有對penicillins(包括Tazocin)藥物過敏的紀錄。* 臨床試驗中Tazocin 4.5 g / 6小時合併一種胺基醣苷類抗生素之常見的副作用包括有腹瀉(17.6%)、發燒 (2.7%)、嘔吐(2.7%)、泌尿道感染 (2.7%)以及紅疹 (2.3%)。
全站熱搜




 留言列表
留言列表
 線上藥物查詢
線上藥物查詢 